|
Leczenie zakażenia w przewlekłym wirusowym zapaleniu
wątroby typu B: Dlaczego, kiedy i w jaki sposób?
Jean-Michel Pawlotsky, lekarz med., doktor n. med.
Universite Paris XII
Creteil, Francja
Komentarz do przypadku: Opcje leczenia u pacjenta z
dodatnim wynikiem oznaczenia HbeAg
Michael Manns, lekarz med. i Katja Deterding, lekarz med.
Medizinische Hochschule Hannover
Hannover, Niemcy
Komentarz do przypadku: Długoterminowe leczenie
antywirusowe w przypadku choroby HBeAg
Cihan Yurdaydin, lekarz med.
Ankara Üniversitesi Tip Fakültesi
Gastroenteroloji Bilim Dali
Ankara, Turcja
Wykładowcy i spis treści
Leczenie zakażenia w przewlekłym wirusowym zapaleniu wątroby typu B:
Dlaczego, kiedy i w jaki sposób?
Jean-Michel Pawlotsky, lekarz med., doktor n. med. (Dyrektor Kursu)
Profesor medycyny
Hôpital Henri Mondor, Université Paris XII
Créteil, Francja
Komentarz do przypadku: Opcje leczenia u pacjenta z dodatnim wynikiem oznaczenia HbeAg
Michael Manns, lekarz med.
Profesor medycyny
Medizinische Hochschule Hannover
Hannover, Niemcy
Katja Deterding, lekarz med.
Medizinische Hochschule Hannover
Hannover, Niemcy
Komentarz do przypadku: Długoterminowe leczenie antywirusowe w przypadku choroby HBeAg(-)
Cihan Yurdaydin, lekarz med.
Profesor Gastroenterologii
Ankara Üniversitesi Tip Fakültesi
Gastroenteroloji Bilim Dali
Ankara, Turcja
Cele szkoleniowe
Po zakończeniu niniejszego kursu uczestnicy powinni być w stanie:
- opisać epidemiologię i naturalną historię zakażenia w przewlekłym wirusowym zapaleniu wątroby typu B (CHB) w Europie,
- ocenić skuteczność dostępnych leków w leczeniu zakażeń CHB HBeAg(+) i HBeAg(-),
- ocenić wpływ oporności na wynik kliniczny i omówić strategie postępowania w związku z opornością na stosowany lek.
Leczenie zakażenia w przewlekłym wirusowym zapaleniu wątroby typu B: Dlaczego, kiedy i w jaki sposób?
Dr Jean-Michel Pawlotsky, lekarz med., doktor n. med.
Epidemiologia zakażeń wirusem zapalenia wątroby typu B i obciążenie przewlekłym typem tej choroby
Szacuje się, że przewlekłe zakażenie wirusem zapalenia wątroby typu B (HBV) dotyczy ponad 350 milionów osób na całym świecie.[1] Przewlekłe wirusowe zapalenie wątroby typu B (CHB) jest uważane za jedną z dziesięciu najważniejszych przyczyn zgonów na świecie spowodowanych przez choroby zakaźne. [2] W Europie, która jest obszarem niskiej lub umiarkowanej zachorowalności, szacuje się, że żyje do 3,5 miliona nosicieli HBV. [3] Zachorowalność jest różna w różnych krajach i podgrupach w każdym kraju. Zachorowalność na przewlekłe zakażenia w Europie Wschodniej, Rosji i krajach śródziemnomorskich jest umiarkowana (1-8%), natomiast w Europie Zachodniej i w Północnej częstość występowania HBV jest niewielka (<1%).[4] W Europie Północnej i Zachodniej większość osób dorosłych zostaje zakażona drogą płciową lub podczas wstrzykiwania narkotyków za pomocą zakażonej igły. Na obszarach umiarkowanej zachorowalności znaczenie mają również zakażenia w okresie okołoporodowym lub w wyniku kontaktów z zakażonymi członkami rodziny. Według Światowej Organizacji Zdrowia (WHO) częstość zakażeń w przeważającej części Europy Zachodniej na HBV waha się od 0-10 na 100 000 osób i do 10-50 na 100 000 osób w krajach Europy Wschodniej. [5] Jednak migracja ludności z obszarów o większej częstości zachorowań wpływa na zmianę profilu zakażeń HBV w Europie, tworząc obszary o większej zachorowalności na przewlekłe zakażenia w krajach o generalnie niskiej częstości zachorowań na HBV. Na przykład niedawne badanie wykazało, że częstość dodatniego wyniku oznaczenia antygenu powierzchniowego wzw B (HBsAg) we Francji wzrosła od 0,2-0,4% na początku lat dziewięćdziesiątych do 0,65% w latach 2003-2004. [6] Największy odsetek nosicielstwa obserwowano u osób urodzonych w Afryce podsaharyjskiej lub na Bliskim Wschodzie (odpowiednio 5,25% i 2.45%). W Tabeli 1 przedstawiono grupy osób, które należy poddawać badaniom przesiewowym na obecność HBsAg i przeciwciał skierowanych przeciwko antygenowi rdzeniowemu wzw B (anty HBc). [7] Osoby z dodatnim wynikiem oznaczenia HBsAg należy poddawać ocenie w zakresie obecności aktywnych replikacji (namnażania się) i choroby wątroby.
Tabela 1. Osoby, które należy poddawać badaniom przesiewowym w zakresie zakażeń HBV. [7]

Naturalna historia choroby i czynniki wpływające na jej przebieg
Przewlekłym nosicielstwem HBV określona jest obecność antygenu HBsAg w surowicy krwi wykryta podczas przynajmniej dwóch badań wykonanych w sześciomiesięcznym odstępie.[4] Ryzyko przewlekłego zakażenia wiąże się z wiekiem, w którym nastąpiło zakażenie. Przewlekłe zakażenie pojawi się u dziewięćdziesięciu procent dzieci zakażonych w okresie okołoporodowym, w porównaniu do 30% u dzieci zakażonych we wczesnym dzieciństwie (1-5 lat) i 1-5% u osób zakażonych w dorosłym życiu. [8,9] Przewlekłe zakażenie wzw B może powodować poważne objawy, m.in. marskość wątroby, schyłkową niewydolność wątroby i pierwotnego raka wątroby. Kumulacyjny pięcioletni odsetek progresji marskości wątroby u pacjentów HBeAg(+) wynosi od 8% do 20%.[10] Ryzyko pierwotnegoraka wątroby jest duże u pacjentów z marskością wątroby (4-6% rocznie).[11-13] Wraz z postępem choroby gwałtowanie rosną koszty opieki, które różnią się w zależności od kraju. Niedawno przeprowadzone badanie wykazało, że średni roczny koszt opieki we Francji w 2001 r. wzrósł z 1093,00 EUR w przypadku przewlekłego wzw B do 8842,00 EUR w przypadku pacjentów z niewyrównaną marskością wątroby.[14] Przewlekłe zakażenie HBV ewoluuje przez kilka kolejnych etapów choroby (Rys. 1).[15] Jednak pacjenci nie zawsze przechodzą kolejne stadia w porządku liniowym.
Rys. 1. Etapy przewlekłego zakażenia wirusowym zapaleniem wątroby typu B.
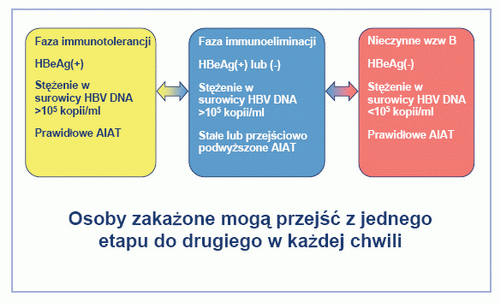
Faza immunotolerancji, która następuje bezpośredni po ostrym epizodzie, charakteryzuje się aktywnym namnażaniem wirusa i słabą odpowiedzią immunologiczną gospodarza, prowadząc do powstania dużych stężeń HBV DNA w surowicy, zwykle towarzyszących obecności antygenu wzw B e (HBeAg), minimalnej aktywności histologicznej i braku objawów. Ten etap może trwać wiele lat, szczególnie u osób zakażonych w okresie okołoporodowym lub we wczesnym dzieciństwie. [15,16]
Podczas fazy immunoeliminacji pojawia się czynne zapalenie wątroby w wyniku odpowiedzi immunologicznej gospodarza na obecność HBV. Stężenia HBV DNA maleją i czasami ulegają wahaniom, podczas gdy stężenia aminotransferazy alaninowej (AIAT) są podwyższone, sygnalizując niszczenie hepatocytów przez układ immunologiczny. Cykl niszczenia i naprawy wątroby powoduje chorobę objawową i postępujące uszkodzenie wątroby, tj, CHB.16 U niektórych pacjentów z CHB wykrywalna jest obecność HBeAg. U tych pacjentów może następować samoistna utrata HBeAg i serokonwersja do anty HBe w tempie około 1-10% rocznie, [10,17] oraz przejście do bezobjawowego stanu nosicielstwa.
Jednak ogromna większość pacjentów z CHB na terenie Europy to pacjenci HBeAg(-) i anty-HBe(+). Rośnie udział pacjentów z chorobą HBeAg(-) w Europie.[4,18] Choroba HBeAg(-) występuje na skutek mutacji w regionie przedrdzeniowym (kodon stop (kodon terminalny) w pozycji 1896) i podstawowego rdzeniowego regionu promotora (nukleotydowe podstawienia w pozycjach 1762 i 1764), które zatrzymują lub osłabiają produkcję HBeAg.[19] W trakcie lub po utracie HBeAg lub serokonwersji do przeciwciał anty HBe nacisk układu immunologicznego na wirusa typu dzikiego prawdopodobnie prowadzi do selekcji wariantów HBeAg(-) jako dominujących wariantów wirusa.
Po serokonwersji HBeAg pacjenci mogą przejść do etapu braku replikacji, „nieaktywnego” stanu nosicielstwa HBV. Nieczynna choroba charakteryzuje się obecnością HBsAg w surowicy, małym lub niewykrywalnym stężeniem HBV DNA, prawidłową czynnością AIAT i brakiem HBeAg.[4] Jednak takim pacjentom zagraża uczynnienie choroby, np. jeśli będą leczeni lekami immunosupresyjnymi, i powinni oni być poddawani regularnej obserwacji. Nieaktywni nosiciele z marskością wątroby również powinni być objęci ścisłą obserwacją, ponieważ zagraża im pojawienie się pierwotnego raka wątroby, niezależnie od poziomu replikacji HBV. U mniejszej części nieaktywnych nosicieli HBV nastąpi samoistna serokonwersja HBsAg. Jednak występuje to u mniej niż 1% pacjentów rocznie. [20]
Kogo należy leczyć?
Jak zasugerowano w niedawnej publikacji „Postępowanie w niewydolności wątroby - Stanowisko American Association for the Study of Liver Diseases” przed rozpoczęciem leczenia konieczne jest dokładne rozważenie wieku pacjenta, nasilenia choroby wątroby, prawdopodobieństwa odpowiedzi i potencjalnych działań niepożądanych.21 W celu oceny ryzyka konieczne jest objęcie pacjentów zakażonych HBV stałą obserwacją. Leczenie jest wskazane, jeśli duże jest ryzyko choroby lub śmiertelności w najbliższej i przewidywalnej przyszłości (5-20 lat) i prawdopodobieństwo osiągnięcia utrzymującej się supresji wirusa po określonym schemacie leczenia lub podczas leczenia. Przeciwnie, leczenie nie jest wskazane, jeśli ryzyko choroby i śmiertelności w wyniku choroby wątroby w ciągu kolejnych 20 lat i prawdopodobieństwo osiągnięcia trwałej supresji wirusa jest małe. [21] Pacjenci HBeAg(+) z CHB powinni być leczeni w momencie, gdy stężenia AIAT dwukrotnie przekraczają górną granicę normy (2 x ULN) lub biopsja wątroby wykazuje umiarkowane lub ciężkie zapalenie wątroby, a stężenie HBV DNA w surowicy przekracza 20 000 jednostek międzynarodowych (j.m.) na mililitr. Leczenie należy opóźnić o 3-6 miesięcy u pacjentów z wyrównaną chorobą wątroby w celu określenia, czy nie następuje samoistna serokonwersja HBeAg, natomiast pacjentów z żółtaczką i podwyższonym stężeniem AIAT należy leczyć
niezwłocznie. [4,21] Należy rozważyć leczenie pacjentów HBeAg(-) z CHB, ze stężeniem HBV DNA w surowicy przekraczającym 20 000 j.m./ml i podwyższonym stężeniem AIAT >2 x ULN. Biopsję wątroby można rozważać przy niższym stężeniu HBV DNA (2000-20 000 j.m./ml) oraz granicznych, prawidłowych lub minimalnie podwyższonych stężeniach AIAT. W tej grupie pacjentów leczenie może być rozpoczęte, jeśli biopsja wykazała istnienie umiarkowanego/ciężkiego stanu zapalnego i znacznego zwłóknienia. [4,21] Pacjentów, u których nie nastąpiła odpowiedź na wcześniejsze leczenie interferonem (INF) alfa lub analogami nukleozydowymi/nukleotydowymi należy ponownie leczyć. Należy rozważyć leczenie doraźne za pomocą alternatywnych schematów leczenia u wszystkich pacjentów z przełomem wirusowym. [21]
Ponadto należy brać pod uwagę leczenie u pacjentów z wyrównaną marskością wątroby ze stężeniem AIAT w surowicy >2 x ULN oraz z prawidłowym i minimalnie podwyższonym stężeniem AIAT, jeśli stężenia HBV DNA w surowicy są duże (>2000 j.m./ml). U pacjentów z niewyrównaną marskością wątroby leczenie należy rozpocząć niezwłocznie. [21]
Opcje leczenia
Obecnie w Europie zarejestrowanych jest pięć leków wskazanych do leczenia przewlekłego zakażenia HBV. Można je podzielić na alfa IFN (standardowy interferon alfa, pegylowana postać interferonu alfa) i analogi nukleozydowe/nukleotydowe (lamiwudyna, adefowir, entekawir). Ponadto szereg leków jest w fazie opracowania, m.in. telbiwudyna, która jest obecnie oceniana przez Europejską Agencję ds. Produktów Leczniczych (EMEA) i powinna zostać wkrótce zatwierdzona. Tenofowir oraz połączenie tenofowiru i emtricitabiny w jednej tabletce są zatwierdzone do stosowania w zakażeniu HIV i obecnie podlegają ocenie III fazy w leczeniu zakażeń HBV.
Interferon alfa
Interferon alfa-2a lub -2b był pierwszym lekiem dostępnym do leczenia przewlekłego zakażenia HBV. Leczenie standardowym IFN alfa wymaga wstrzyknięć podskórnych. Lek jest podawany przez 16-24 tygodnie u pacjentów HBeAg(+) z CHB i przez 48 tygodni u pacjentów HBeAg(-). Metaanaliza wyników badań IFN u pacjentów HBeAg(+) z CHB (łącznie n=837 pacjentów) wykazała, że u 37% pacjentów nastąpiło zahamowanie replikacji HBV DNA poniżej 105 kopii/ml, u 33% nastąpiła utrata HBeAg, a 8% wykazywało utratę HBsAg. Wszystkie odsetki były statystycznie wyższe niż odsetki w grupie placebo. [22] Długookresowe badanie kontrolne (mediana 4,7 lat) wykazało, że u 88% respondentów uzyskano trwałą supresję antywirusową (HBV DNA <105 kopii/ml). [23] Nie jest oczywiste, czy u pacjentów HBeAg(-) z CHB następuje odpowiedź na krótkotrwałe leczenie IFN alfa. Podczas gdy u 28-69% pacjentów osiągnięto HBV DNA <105 kopii/ml i normalizację stężenia AIAT na koniec leczenia, trudno jest określić odpowiedź po leczeniu. [24-27] Jedno badanie podaje, że 72 miesiące po zakończeniu leczenia 27% pacjentów miało niskie stężenie HBV DNA i prawidłowe stężenie AIAT. [28] Niektórzy z tych pacjentów mogą uzyskać serokonwersję HBsAg, jednak nie zdarza się to często.
Tabela 2. Wyniki badań standardowej i pegylowanej postaci IFN alfa u pacjentów HBeAg(+) HBeAg(-) z CHB (przystosowano na podstawie przypisu 21). Nd.: nie dostępne
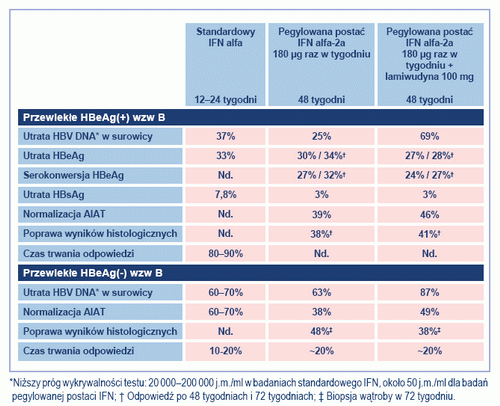
Pegylowana postać IFN alfa-2a oferuje możliwość podawania leku podskórnie raz w tygodniu w dawce 180 µg przez 48 tygodni, zarówno u pacjentów HBeAg(+), jak i HBeAg(-). Ocen skuteczności leczenia dokonywano za pomocą bardziej czułych metod diagnostycznych oznaczania HBV DNA niż metody stosowane podczas zasadniczych badań klinicznych konwencjonalnej postaci interferonu. U pacjentów HBeAg(+) 48-tygodniowe leczenie spowodowało supresję HBV DNA do <400 kopii/ml u 25%, normalizację AIAT u 46% i serokonwersję HBeAg u 24% pacjentów badanej kohorty.[29] Jednak 24 tygodnie po przerwaniu leczenia jedynie u 14% pacjentów stężenie HBV DNA wynosiło <400 kopii/ml. Wraz z wydłużaniem czasu kontroli, odsetek serokonwersji HBeAg wzrastał, wynosząc 42% w 48 tygodni po zakończeniu leczenia.[30] U pacjentów HBeAg(-) 48-tygodniowe leczenie pegylowaną postacią IFN alfa-2a spowodowało obniżenie stężenia HBV DNA <400 kopii/ml u 73%, a u pięciu pacjentów uzyskano serokonwersję i pojawienie się przeciwciał anty-HBs.31 Jednak 12 miesięcy po zakończeniu leczenia jedynie u 17% pacjentów stężenie HBV DNA było niewykrywalne.[32] Tabela 2 stanowi zestawienie wyników badań IFN w leczeniu przewlekłego zakażenia HBV.
Analogi nukleozydowe/nukleotydowe
Analogi nukleozydowe/nukleotydowe podawane są doustnie. Pacjent przyjmuje je raz dziennie, a dawka jest inna dla każdego leku: lamiwudyna 100 mg; adefowir 10 mg; entekawir 0,5 mg u pacjentów dotąd nie stosujących nukleozydów, 1,0 mg u pacjentów z opornością na lamiwudynę; telbiwudyna 600 mg. Wszystkie analogi nukleozydowe/nukleotydowe powodują hamowanie replikacji wirusa, normalizację stężenia AIAT, poprawę wyników oznaczeń histologicznych i pozytywną odpowiedź kliniczną u dużej części pacjentów.
Kliniczne wykorzystanie analogów nukleozydowych/nukleotydowych zależy od ich odpowiednich rzeczywistych właściwości antywirusowych i profilu oporności (w tym oporności krzyżowej). Średni log10 obniżenia obciążenia wirusem po rocznym leczeniu u pacjentów HBeAg(+) jest największy średnio w przypadku stosowania entekawiru (-6,9 log10 kopii/ml), w porównaniu do telbiwudyny (-6,5 log10 kopii/ml), lamiwudyny (od -4,0 do -5,5 log10 kopii/ml) i adefowiru (-3,5 log10 kopii/ml).[32-34] U pacjentów HBeAg(-) 48-tygodniowe leczenie powoduje supresję HBV DNA do stężenia poniżej 400 kopii/ml u 51%, 61% i 91% pacjentów otrzymujących odpowiednio adefowir, lamiwudynę i entekawir. [34-36] Dane zaczerpnięto z nie-porównawczych badań klinicznych. Obecnie dostępne stają się dane długoterminowe, które wykazują wzrost odsetka odpowiedzi w przypadku długotrwałego leczenia. Tenofowir jest wyłącznie zatwierdzony do leczenia zakażeń HIV, ale prowadzone są badania kliniczne III fazy stosowania tego leku w zakażeniu HBV. Tenofowir wywiera silniejsze działanie niż adefowir u pacjentów zakażonych HBV.
Tabela 3 stanowi zestawienie wyników badań analogów nukleozydowych/nukleotydowych w leczeniu przewlekłego zakażenia HBV.
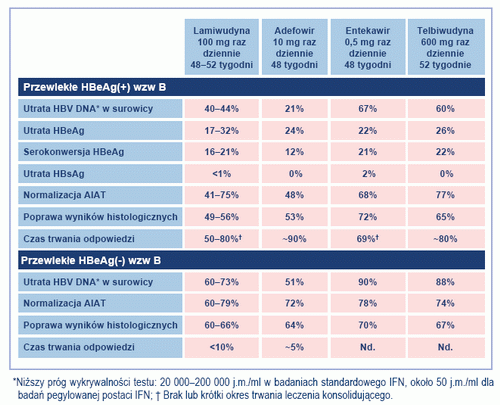
Częstość występowania oporności na lamiwudynę pozostaje problemem klinicznym i występuje u 14-32% pacjentów po roku leczenia, u 38% po dwóch latach leczenia i u 53-76% po trzech latach leczenia. [37] Główne mutacje związane z opornością na lamiwudynę znajdują się w sekwencji katalitycznej YMDD odwrotnej transkryptazy HBV. Obejmują M204V (sekwencja YVDD), M204I (YIDD) i rzadko M204S (YSDD). [38] Często jednocześnie wybierane są dodatkowe podstawienia, takie jak L180M i V173L. Oporność na lamiwudynę zmniejsza podatność na entekawir i powoduje całkowitą oporność na telbiwudynę, jeśli jest jako podstawienie M204I (YIDD). Oporność na telbiwudynę występuje odpowiednio u 22% i 9% wcześniej nie leczonych pacjentów HBeAg(+) i (-) po rokupodawania leku, z wszystkimi wariantami oporności z podstawieniem M204I (YIDD). [34] Pełna oporność na entekawir wynika z trójetapowego procesu akumulacji selekcji mutacji, obejmującego sekwencję podstawień oporności lamiwudyny w pozycji 204 (M204V i M204I), podstawienie rtL180M, które poprawia możliwości replikacji wariantów oporności na lamiwudynę i jedno lub więcej podstawień specyficznych dla entekawiru (T184S/A/I/L, S202G/C i M250I/V), które przywraca pełną replikację w obecności entekawiru. [39] Kumulacyjne prawdopodobieństwo wirusowego przełomu spowodowanego pojawieniem się oporności na entekawir wynosi 0,8% u pacjentów leczonych po raz pierwszy, a u pacjentów z opornością na lamiwudynę jest rzędu 39.5% po czterech latach podawania. [40]
Oporność HBV na dipiwoksyl adefowiru jest złożona. Wykazano, że długoterminowe podawanie powoduje selekcję wariantu N236T lub A181V. Pojawianie się oporności na adefowir następuje wolno, ale po pięciu latach monoterapii selekcja wariantów opornych na adefowir wyniosła 29% przypadków.[41] Mutacje powodujące oporność na adefowir nie wykazują znacznej oporności krzyżowej na lamiwudynę, telbiwudynę lub entekawir, oprócz być może podstawienia A181T, które może wykazywać zmniejszoną podatność na lamiwudynę. Tenofowir jest wyłącznie zatwierdzony do leczenia zakażeń HIV, ale prowadzone są badania kliniczne III fazy stosowania tego leku w zakażeniu HBV. Dotąd dla tenofowiru niezidentyfikowano wyraźnie mutacji oporności, która wykazuje oporność krzyżową in vitro z lamiwudyną, telbiwudyną lub entekawirem.
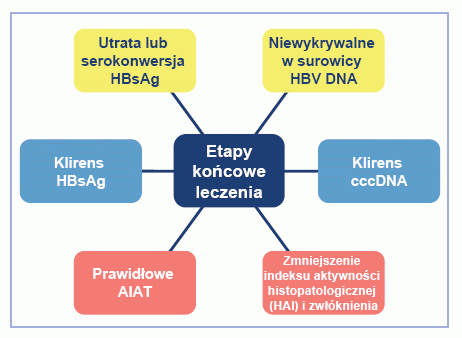
Etapy końcowe leczenia
Określenie etapów końcowych leczenia ma istotne znaczenie w leczeniu przewlekłego zakażenia HBV, ponieważ zlikwidowanie zakażenia nie jest możliwe za pomocą obecnie dostępnych leków. Można wykorzystać wirusowe, biochemiczne, serologiczne i kliniczne etapy końcowe (Rys. 2). Serokonwersja do anty-HBs jest idealnym etapem końcowym, jednak jest rzadko uzyskiwana.[4] U pacjentów HBeAg(+) z CHB celem jest serokonwersja do przeciwciał anty-HBe przy niższych lub niewykrywalnych stężeniach HBV DNA i normalizacji stężenia AIAT. Cel ten można osiągnąć za pomocą krótkoterminowego leczenia u niektórych pacjentów HBeAg(+). U pacjentów z HBeAg(-) oraz u pacjentów HBeAg(+) z CHB, u których nie zdołano osiągnąć serokonwersji HBeAg po krótkim leczeniu, celem jest trwała supresja wirusa, która zapewni zmniejszenie stanu martwiczo-zapalnego wątroby i zapobiegnie wystąpieniu powikłań choroby wątroby.
Jak leczyć?
Obecnie brak jest jednolitego konsensusu odnośnie wskazań do leczenia HBV. Zgodnie z obowiązującym schematem leczenia, krótkotrwałe leczenie pegylowaną postacią IFN alfa jest wskazane u pacjentów HBeAg(+) z dużym prawdopodobieństwem serokonwersji HBeAg (takich jak pacjenci z małym obciążeniem wirusowym i wysokimi stężeniami aminotransferazy w surowicy). Jednak ostatnio zasugerowano, że podobne odsetki serokonwersji HBeAg można uzyskać w ciągu dwóch lub trzech lat leczenia doustnym analogiem nukleozydowym/nukleotydowym (prawdopodobnie w tych samych podgrupach pacjentów) przy lepszym profilu działań niepożądanych. [32,42] U pacjentów HBeAg(-), pacjentów HBeAg(+) z małym prawdopodobieństwem serokonwersji HBeAg oraz u pacjentów, u których nie udało się uzyskać serokonwersji podczas leczenia IFN alfa należy stosować inhibitory nukleozydowe/nukleotydowe. W większości przypadków będą one stosowane przez całe życie, ponieważ leki te wywierają jedynie działanie wirusostatyczne, co oznacza, że replikacja wirusa rozpoczyna się wkrótce po ich odstawieniu i ponownie następuje progresja choroby wątroby.
Rys. 2. Etapy końcowe leczenia przewlekłego zakażenia wirusowym zapaleniem wątroby typu B.
- U pacjentów dotychczas nieleczonych: biorąc pod uwagę, że analogi będą musiały być podawane przez wiele lat oraz prawdopodobieństwo wczesnego wystąpienia oporności na lamiwudynę, adefowir i telbiwudynę, prawdopodobnie leki te należy stosować w leczeniu skojarzonym w celu uniknięcia oporności krzyżowej, tj. lamiwudyna plus adefowir lub telbiwudyna plus adefowir. Jednak biorąc pod uwagę korzystny profil oporności i nowe dane dotyczące dłuższego okresu kontroli, entekawir można stosować w monoterapii u pacjentów bez zwłóknienia lub z umiarkowanym zwłóknieniem. U pacjentów z najcięższymi zakażeniami należy zachować ostrożność i stosować leczenie skojarzone lamiwudyną, telbiwudyną lub entekawirem z adefowirem. U pacjentów z suboptymalną odpowiedzią na adefowir można zastosować tenofowir. Tenofowir prawdopodobnie zastąpi adefowir w takim leczeniu skojarzonym z chwilą jego zatwierdzenia.
- U pacjentów z opornością na lamiwudynę badania donoszą o skuteczności leczenia skojarzonego obejmującego lamiwudynę i adefowir / tenofowir lub przestawienie pacjenta na entekawir. Przyszłe badania mogą potwierdzić inne strategie, np. entekawir plus adefowir lub, po zatwierdzeniu, tenofowir.[43,44]
Jak monitorować leczenie?
W przypadku leczenia opartego na IFN niepowodzenie leczenia określa się jako brak uzyskania serokonwersji HBeAg w trakcie leczenia lub po jego zakończeniu. Można przewidywać takie niepowodzenie, jeśli obniżenie HBV DNA po sześciu miesiącach leczenia jest umiarkowane lub niewielkie. Brak odpowiedzi na leczenie analogami nukleozydowymi/nukleotydowymi, określany również jako niepowodzenie pierwszego leczenia, jest niepowodzeniem w uzyskaniu zmniejszenia stężenia HBV DNA o ponad 1 log10 podczas pierwszych trzech miesięcy leczenia. U niektórych pacjentów może wystąpić suboptymalna odpowiedź charakteryzująca się spadkiem o ponad 1 log10, lecz mniej niż 2-3 log10 w trzecim miesiącu leczenia. [36] Niepowodzenie drugiej terapii antywirusowej określa się jako wzrost z odbicia stężenia HBV DNA w surowicy o ponad 1 log10 ponad nadir u pacjentów, u których początkowo nastąpiła odpowiedź. Pojawienie się oporności na lek antywirusowy stanowi podstawową przyczynę niepowodzenia drugiej terapii.[45]
W praktyce klinicznej oceny stężeń HBV DNA, AIAT i HBeAg / anty-HBe należy wykonać na początku leczenia, a następnie co trzy miesiące. Jeśli podejrzewa się u pacjenta niepowodzenie pierwszej lub drugiej terapii bez podwyższenia stężenia AIAT, należy to potwierdzić za pomocą drugiego pomiaru stężenia HBV DNA. W przypadku niepowodzenia pierwszej lub drugiej terapii należy ocenić przestrzeganie poleceń lekarskich przez pacjenta, w razie konieczności za pomocą dawkowania leku. U pacjentów przestrzegających poleceń lekarskich coraz częściej stosuje się testy oporności w celu jej wykazania i umożliwienia podjęcia świadomej decyzji o dalszym leczeniu. W najbliższej przyszłości należy jednak wydać jednolite wytyczne odnośnie podejmowania decyzji dotyczących leczenia pacjenta zgodnie z jego profilem oporności.
Wpływ pomyślnego leczenia
Dostępne obecnie schematy leczenia nie mogą wyeliminować HBV w związku z trwałym kowalentnie zamkniętym okrągłym DNA (cccDNA) prowirusa obecnym w jądrach hepatocytów. Niemniej jednak kilka badań wykazało korzystny wpływ leczenia na wynik kliniczny.[48-48] Niederau i wsp. wykazał, że utracie HBeAg podczas konwencjonalnego leczenia IFN alfa towarzyszy znamiennie dłuższy ogólny czas przeżycia i przeżycie bez powikłań.[46] Badanie prowadzone przez Liaw i wsp. badające wpływ leczenia lamiwudyną u pacjentów z marskością wątroby lub zaawansowanym zwłóknieniem doniosło, że lamiwudyna wiąże się z mniejszą częstością progresji choroby niż placebo. Jednak selekcja mutacji opornych na lamiwudynę osłabiła korzyści wynikające z leczenia lamiwudyną.[47]
Przeprowadzone niedawno pięcioletnie badanie adefowiru u pacjentów HBeAg(-) wykazało poprawę w zakresie zwłóknienia wątroby:[48] U 71% pacjentów wykazano ponad jednopunktowe zmniejszenie oceny zwłóknienia w skali Ishaka po pięciu latach kontynuacji leczenia. Donoszono również o poprawie oceny histologicznej w związku z leczeniem entekawirem. U pacjentów nie leczonych wcześniej nukleozydami, 48-tygodniowe leczenie entekawirem wiązało się z poprawą histologiczną (określoną jako ponad dwupunktowa poprawa w skali martwiczozapalnej Knodella i brak pogorszenia obrazu zwłóknienia w skali Knodella) odpowiednio u 72% i 70% pacjentów HBeAg(+) i HBeAg(-).[35] Natomiast 48-tygodniowe leczenie pegylowaną postacią IFN alfa-2a spowodowało histologiczną poprawę odpowiednio u 38% i 15% pacjentów HBeAg(+) i HBeAg(-).[29,31]
Wnioski
Zważywszy że 3,5 miliona osób w Europie jest przewlekle zakażonych, przewlekłe zakażenie HBV jest poważnym problemem zdrowotnym społeczeństwa. Wraz z rosnącą liczbą przypadków HBeAg(-) i wywierającą duży wpływ migracją ludności, profil choroby ulega zmianie. Skuteczne zidentyfikowanie osób przewlekle zakażonych i podjęcie optymalnego leczenia ma ogromne znaczenie w zmniejszeniu ryzyka progresji choroby. Ewoluujące dane dotyczące naturalnej historii CHB oraz wpływ leczenia wraz z dostępnymi coraz lepszymi lekami spowoduje zmianę modeli leczenia.
Piśmiennictwo
[1]. Maynard JE. Hepatitis B: Global importance and need for control. Vaccine 1990; 8(Suppl.): S18-20.
[2]. Hoofnagle JH. Chronic hepatitis B. N Engl J Med 1990; 323: 337-9.
[3]. Custer B, Sullivan SD, Hazlet TK, et al. Global epidemiology of hepatitis B virus. J Clin Gastroenterol 2004; 38(10 Suppl.): S158-68.
[4]. de Franchis R, Hadengue A, Lau G, et al. EASL Jury. EASL International Consensus Conference on hepatitis B. Consensus statement (long version). J Hepatol 2003; 39(Suppl. 1): S3-25.
[5]. World Health Organisation. Hepatitis B incidence Euroregion 1990-2004. Available at: http://data.euro.who.int/CISID/DOC/HepB/HepB_incidence_euroregion_1990-2004.pps (Accessed June 29, 2007).
[6]. Meffre C, Le Strat Y, Delarocque-Astagneau E, et al. Prevalence of hepatitis B in France, 2003-2004. J Hepatol 2006; 44(Suppl. 2): S22.
[7]. McMahon BJ. Selecting appropriate management strategies for chronic hepatitis B: Who to treat. Am J Gastroenterol 2006; 101(Suppl. 1): S7-12.
[8]. McMahon BJ, Alward WL, Hall DB, et al. Acute hepatitis B virus infection: relation of age to the clinical expression of disease and subsequent development of the carrier state. J Infect Dis 1985; 151: 599-603.
[9]. Tassopoulos NC, Papaevangelou GJ, Sjorgren MH, et al. Natural history of acute hepatitis B surface antigen-positive hepatitis in Greek adults. Gastroenterology 1987; 92: 1844-50.
[10]. Fattovich G, Brollo L, Giustina G, et al. Natural history and progression factors for chronic hepatitis type B. Gut 1991; 32: 294-8.
[11]. de Franchis R, Meucci G, Vecchi M, et al. The natural history of asymptomatic hepatitis B surface antigen carriers. Ann Intern Med 1993; 118: 191-4.
[12]. Yu MW, Hsu FC, Sheen IS, et al. Prospective study of hepatocellular carcinoma and liver cirrhosis in asymptomatic chronic hepatitis B virus carriers. Am J Epidemiol 1997; 145: 1039-47.
[13]. Ikeda K, Saitoh S, Suzuki Y, et al. Disease progression and hepatocellular carcinogenesis in patients with chronic viral hepatitis: a prospective observation
of 2215 patients. J Hepatol 1998; 28: 930-8.
[14]. Brown RE, De Cock E, Colin X, et al. Hepatitis B management costs in France, Italy, Spain, and the United Kingdom. J Clin Gastroenterol 2004; 38 (10 Suppl.): S169-74.
[15]. Lee WM. Hepatitis B virus infection. N Engl J Med 1997; 337: 1733-45.
[16]. Kao JH & Chen DS. The natural history of hepatitis B virus infection. In: Lai CL, Locarnini S (eds). Hepatitis B virus. London: International Medical Press, 2002: 1612-72.
[17]. Lok AS. Natural history and control of perinatally acquired hepatitis B virus infection. Dig Dis 1992; 10: 46-52.
[18]. Zarski JP, Marcellin P, Leroy V, et al. Federation nationale des Poles de reference et des Reseaux Hepatites. Characteristics of patients with chronic hepatitis B in France: Predominant frequency of HBe antigen-negative cases. J Hepatol 2006; 45: 355-60.
[19]. Ganem D and Prince AM. Hepatitis B virus infection - natural history and clinical consequences. N Engl J Med 2004; 350: 1118-29.
[20]. Tang JR, Hsu HY, Lin HH, et al. Hepatitis B surface antigenemia at birth: A long-term follow-up study. J Pediatr 1998; 133: 374-7.
[21]. Lok AS and McMahon BJ. Chronic hepatitis B. Hepatology 2007; 45: 507-39.
[22]. Wong DK, Cheung AM, O’Rourke K, et al. Effect of alpha-interferon treatment in patients with hepatitis B e antigen-positive chronic hepatitis B Ann Intern Med 1993; 119: 312-23.
[23]. Krogsgaard K. The long-term effect of treatment with interferon-alpha 2a in chronic hepatitis B. The European Study Group on Viral Hepatitis (EUROHEP). Executive Team on Anti-Viral Treatment. J Viral Hepat 1998; 5: 389-97.
[24]. Manesis EK and Hadziyannis SJ. Interferon alpha treatment and retreatment of hepatitis B e antigen-negative chronic hepatitis B. Gastroenterology 2001; 121: 101-9.
[25]. Lampertico P, Del Ninno E, Manzin A, et al. A randomized, controlled trial of a 24 month course of interferon alfa 2b in patients with chronic hepatitis B who had hepatitis B virus DNA without hepatitis B e antigen in serum. Hepatology 1997; 26: 1621-5.
[26]. Oliveri F, Santantonio T, Bellati G, et al. Long-term response to therapy of chronic anti HBe-positive hepatitis B is poor independent of type and schedule of interferon. Am J Gastroenterol 1999; 94: 1366-72.
[27]. Brunetto MR, Oliveri F, Coco B, et al. Outcome of anti-HBe-positive chronic hepatitis B in alpha-interferon treated and untreated patients: A long term cohort study. J Hepatol 2002; 36: 263-70.
[28]. Papatheodoridis GV, Manesis E, Hadziyannis SJ. The long-term outcome of interferon-alpha treated and untreated patients with HBeAg-negative chronic hepatitis B. J Hepatol 2001; 34: 306-13.
[29]. Lau GKK, Piratvisuth T, Luo KX, et al; Peginterferon Alfa-2a HBeAg-Positive Chronic Hepatitis B Study Group. Peginterferon alfa-2a, lamivudine, and the combination for HBeAg-positive chronic hepatitis B. N Engl J Med 2005; 352: 2682-95.
[30]. Lau GKK, Piratvisuth T, Luo KX, et al. Durability of response and occurrence of late response to peginterferon alfa-2a (40 kD) (Pegasys) one year post-treatment in patients with HBeAg-positive chronic hepatitis B. J Hepatol 2006; 44(Suppl. 2): S23.
[31]. Lau GK, Bonino F, et al; Peginterferon Alfa-2a HBeAg-Positive Chronic Hepatitis B Study Group. Peginteferon alfa-2a alone, lamivudine alone, and the two in combination in patients with HBeAg-negative chronic hepatitis B. N Engl J Med 2004; 351: 1206-17.
[32]. Marcellin P, Chang T, Lim S. Increasing serologic, virologic, and biochemical response over time to adefovir dipivoxil 10 mg in HBeAg-positive chronic hepatitis B patients. J Hepatol 2005; 42(Suppl. 2): 31.
[33]. Chang TT, Gish R, de Man R, et al; BEHoLD AI463022 Study Group. A comparison of entecavir and lamivudine for HBeAg-positive chronic hepatitis B. N Engl J Med 2006; 354: 1001-10.
[34]. Lai CL, Gane E, Hsu CW, et al. Two-year results from the GLOBE trial in patients with hepatitis B: Greater clinical and antiviral efficacy for telbivudine (LDT) vs lamivudine. Hepatology 2006; 44(4 Suppl. 1): 222A.
[35]. Lai CL, Shouval D, Lok AS, et al. Entecavir versus lamivudine for patients with HBeAg-negative chronic hepatitis B. N Engl J Med 2006; 354: 1011-20.
[36]. Hadziyannis SJ, Tassopoulos NC, Heathcote EJ, et al. Adefovir Dipivoxil 438 Study Group. Adefovir dipivoxil for the treatment of hepatitis B e antigennegative chronic hepatitis B. N Engl Med 2003; 348: 800-7.
[37]. Lai CL, Dienstag J, Schiff E, et al. Prevalence and clinical correlates of YMDD variants during lamivudine therapy for patients with chronic hepatitis B. Clin Infect Dis 2003; 36: 687-96.
[38]. Allen MI, Deslauriers M, Andrews CW, et al. Identification and characterization of mutations in hepatitis B virus resistant to lamivudine. Hepatology 1998; 27: 1670-7.
[39]. Tenney DJ, Levine SM, Rose RE, et al. Clinical emergence of entecavir-resistant hepatitis B virus requires additional substitutions in virus already resistant to lamivudine. Antimicrob Agents Chemother 2004; 48: 3498-507.
[40]. Colonno RJ, Rose RE, Pokornowski K, et al. Four year assessment of ETV resistance in nucleoside-naive and lamivudine refractory patients. J Hepatol 2007; 46 (Suppl. 1): S294.
[41]. Borroto-Esoda K, Arterburn S, Snow A, et al. Final analysis of virological outcomes and resistance during 5 years of adefovir dipivoxil monotherapy in HBeAg-negative patients. J Hepatol 2006; 44(Suppl. 2): S179.
[42]. Gish RG, Chang TT, de Man et al. Entecavir results in substantial virologic and biochemical improvement and HBeAg seroconversion through 96 weeks of treatment in HBeAg(+) chronic hepatitis B patients (Study ETV 022). Hepatology 2005; 42(Suppl. 1): 267A.
[43]. Fung SK, Chae HB, Fontana RJ, et al. Virologic response and resistance to adefovir in patients with chronic hepatitis B. J Hepatol 2006; 44: 283-90.
[44]. Sherman M, Yurdaydin C, Sollano J, et al. Entecavir for treatment of lamivudine-refractory, HBeAg-positive chronic hepatitis B. Gastroenterology 2006; 130: 2039-49.
[45]. Locarnini S, Hatzakis A, Heathcote J. et al. Management of antiviral resistance in patients with chronic hepatitis B. Antivir Ther 2004; 9: 679-93.
[46]. Niederau C, Heinteges T, Lange S, et al. Long-term follow-up of HBeAg-positive patients treated with interferon alfa for chronic hepatitis B. N Engl J Med 1996; 334: 1422-7.
[47]. Liaw YF, Sung JJ, Chow WC, et al. Cirrhosis Asian Lamivudine Multicentre Study Group. Lamivudine for patients with chronic hepatitis B and advanced liver disease. N Engl J Med 2004; 351: 1521-31.
[48] Hadziyannis S, Tassopoulos N, Chang TT, et al. Long-term adefovir dipivoxil treatment induces regression of liver fibrosis in patients with HBeAg-negative
chronic hepatitis B: Results after 5 years of therapy. Hepatology 2005; 42(4 Suppl. 1): 754A (abstract # LB14).
Pomoc finansowa jest w postaci niezależnego grantu firmy Bristol-Myers Squibb (BMS) przeznaczonego na cele szkolenia medycznego. Opinie przedstawione w pracy są indywidualnymi poglądami autorów nie zawsze zgodnymi z opiniami firmy BMS z uwagi na fakt, że firma BMS nie miała udziału w pracach ani wpływu na zawarte w nich treści.
Źródło: http://www.scicme.com/ Z PDF-u przerobi³ Jarek Chojnacki
C.D.N. :)
|